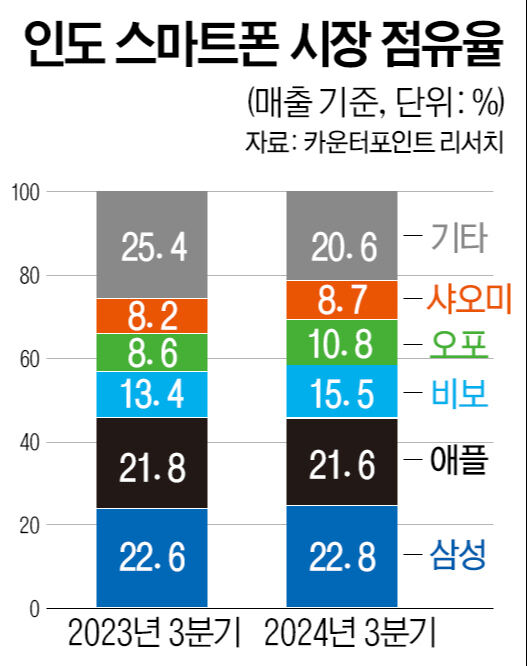
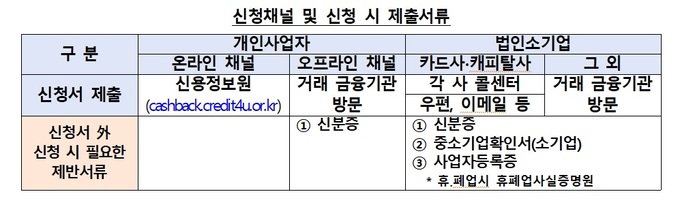
㈜엑소코바이오는 최근 줄기세포 엑소좀 신약후보물질인 ‘EXO101’의 임상 시험 진입 전단계인 동물 안전성 시험에 착수했다고 9일 밝혔다.
엑소코바이오에 따르면 이번 비임상 독성시험은 15억 원을 투자하여 글로벌 독성 시험 기업인 찰스 리버 랩(Charles River Laboratories)에서 진행되며 일반독성시험, 유전독성, 면역독성, 안전성약리시험 등 미국 FDA에서 요구되는 임상 시험 수준에 부합하는 독성 시험들을 실시할 계획이다.
이를 위해 지난 8월 말에 엑소코바이오의 세계 최대 엑소좀 GMP 생산시설인 ExoGMP™ 시설에서 정맥 주사 수준의 고품질 엑소좀을 생산했으며 미국 찰스 리버 랩(Charles River Laboratories)에서 이송 완료했다.
이번 글로벌 시험 기준에 맞춘 독성시험 결과를 통해 엑소코바이오가 엑소좀의 글로벌 안전성 표준을 만들어가고자 한다. 이는 치료제 시장뿐 아니라 메디컬 에스테틱 시장에서 난립하고 있는 엑소좀 화장품에 대한 까다로운 안전성 표준을 제시하고 소비자에게 혼선을 야기하는 유사 엑소좀과의 구분이 될 것으로 기대한다. 현재 안전성이 검증되지 않은 유사 엑소좀 화장품에 대한 여러 부작용이 시장에 보고되고 있는 상황에서 바이오기업들 내에서도 자성의 목소리가 커지고 있어 해당 글로벌 기준에 맞춘 독성시험이 엑소좀 시장 확장에 매우 중요한 지렛대가 될 것으로 보고 있다고 업체 측은 전했다.
글로벌 시장 조사 기관인 DataQuest Insights 사에 따르면 만성 피부염 치료제 시장은 2024년 7조 원, 2031년까지 매년 11%씩 성장하여 2031년 15조 원으로 성장할 것으로 전망하고 있다. 이와는 별도로 여성 건강과 밀접하게 관련된 태선 경화증은 아직까지 표준 치료제가 없어 수억 명의 여성들이 고통을 겪고 있는 분야로 알려져 있다. 그런데, 최근 해외 유명 OB/GY 의사들을 통해 엑소코바이오의 줄기세포 엑소좀 기술이 큰 도움을 줄 수 표준 치료제로 개발될 가능성이 있는 것으로 확인됐다는 것이 업체 측 설명이다.
엑소코바이오는 지난 8년 간의 다양한 선행 연구를 통해 줄기세포 엑소좀의 1) 재생, 2) 항염, 3) 항가려움증 등에 대한 효능, 안전성, 메커니즘을 규명했으며 최근까지 28편의 국제 학술 논문과 72개의 특허를 확보했다. 이를 바탕으로 피부염, 경화성 태선 등 다양한 난치성 만성 염증 질환에 대한 엑소좀 신약 개발 가능성을 확인했다.
엑소코바이오 조병성 대표는 “줄기세포 엑소좀은 지난 20년 이상 학술적 임상적 연구에서 부작용없이 안전한 것으로 알려진 바 있으며 당사 줄기세포 엑소좀도 독성이 나타나지 않을 것이라 확신한다. 특히, 지난 8년 간의 연구개발로 줄기세포 엑소좀에 최적화된 제조 공정과 품질 관리 방법을 수립했다. 신속하게 2025년 말까지 미국 FDA 등에 해외 임상 시험을 신청하여 신약개발의 새로운 지평을 열고자 한다”라고 언급했다.
해당 기업의 아토피 피부염 신약 개발 프로젝트는 (재)범부처재생의료기술개발사업단(단장 조인호)의 과제로 선정됐으며 일부 연구개발 자금을 지원받아 수행중이다. 최근 5년 간 400억 원을 투자한 오송 ExoGMP™ 시설은 세계 최대 엑소좀 제조 시설로서 임상 의약품 제조 및 CDMO 위탁 생산을 위해 적격성 평가가 완료된 300개의 장비와 360개의 표준작업지시서를 구축하였다. 또한 2022년도에 첨단바이오의약품 제조업 허가증을 획득한 바 있다고 밝혔다.
황지혜 기자